INTRODUCTION
La BAPIE (ASBL) est l’association professionnelle qui regroupe les grossistes importateurs, exportateurs et distributeurs parallèles de médicaments en Belgique. Ces grossistes « short range » ont en stock une gamme limitée de médicaments mais qu’ils connaissent bien puisqu’ils ont obtenu pour chacun d’entre eux une Autorisation de Mise sur le Marché – à ne pas confondre avec les grossistes -répartiteurs, qui stockent toute la gamme des médicaments en leur magasin sans aucune AMM. La BAPIE a été créée en 2012 ; elle célébrera en 2022 ses dix ans d’existence. Ses membres englobent l’essentiel des sociétés actives dans ce domaine. Leur activité représente 3.7% du marché belge des médicaments d’officine en 2021, contre 2% en 2019.
L’IMPORTATION PARALLELE EST LA SEULE CONCURRENCE POUR LES MEDICAMENTS SOUS BREVET
En important des produits, les importateurs parallèles, par la part de marché qu’ils prennent sur un produit, entrainent une pression baissière sur les prix. Sans cette concurrence, l’industrie pharmaceutique n’aurait aucun challenge sur la structure de prix mise en place. Plusieurs exemples (Livial, Lipitor…) ont montré des baisses significatives de prix au profit du patient et du budget de santé, suite au succès commercial des produits d’importation parallèle. En effet, quand l’importation parallèle prend une grande part de marché sur un produit, le laboratoire de référence n’a pas d’autres solutions que de baisser ses prix – à un niveau où l’importateur parallèle ne peut plus suivre – pour regagner la part de marché perdue. Il convient donc de faciliter l’obtention et la rapidité du traitement des dossiers d’AMM parallèles. Par la pression baissière sur les prix qu’elle apporte, l’importation parallèle joue un rôle de gardien de la concurrence. Quand des baisses de prix sont obtenues à l’étranger par des collègues importateurs, cette pression se répercute aussi sur la Belgique, par le système des prix de référence. Enfin, des hausses de prix en Belgique sont évitées, car celles-ci contribueraient à créer des opportunités de concurrence pour le commerce parallèle.
Il est bon de rappeler que :
- Chacun de nos membres a reçu de l’AFMPS le statut de grossiste en produits pharmaceutiques et est contrôlée par elle.
- Chaque société dispose d’un pharmacien responsable qui établit les procédures suivant lesquelles la société fonctionne.
- Tous nos membres obéissent aux normes GDP (Good Distribution Practices) et les importateurs et distributeurs obéissent en plus aux normes GMP (Good Manufacturing Practices) pour leurs opérations de re-packaging dans des installations agréées.
- Nos membres n’achètent leurs médicaments qu’au sein de l’UE.
- Ils exercent leurs activités dans le strict respect des lois. Parmi celles-ci, ils sont soumis à l’obligation PSO (Public Service Obligation : approvisionnement national d’abord, avant toute exportation). Voir l’article 81 de la directive européenne 2001/83/EC et, en Belgique, l’AR du 19 avril 2001.
- Les membres de la BAPIE se soumettent, statutairement, à un audit indépendant réalisé par TÜV. Cet audit va au-delà des obligations GDP et attache une attention particulière à la chaine d’approvisionnement de chacun des membres. On y vérifie entre autres que nous n’exportons pas de produits critiques en manque sur notre marché. Nos collègues étrangers, soumis eux-aussi à cet audit TÜV, n’exportent pas de produits frappés d’export ban dans leur pays. On peut donc en déduire que ce courant d’import-export n’entraine pas de manquements dans un pays particulier de l’UE mais contribue au contraire à répondre à la demande de chaque pays, tout en exerçant une pression baissière au niveau des prix.
1. Les membres de la BAPIE contribuent à la lutte contre la pénurie des médicaments
- On rapporte régulièrement des ruptures dans la chaine d’approvisionnement dans notre pays mais aussi en Europe et dans le monde. Le site de l’AFMPS donne la cause de ces manquants : dans 49 % des cas, la rupture est due à des retards de livraison, dans 15% à des problèmes de production, dans 13 % à des retards dans la production, dans 4,6 % à une hausse de la demande ; dans 2,8% à des problèmes logistique (transport, douane), dans 2 % au fait que la substance active (API) n’est plus disponible, dans 13 % « une autre raison » est invoquée. En résumé, toutes des causes liées à l’(in)organisation de certaines sociétés de l’industrie pharmaceutique.
- On sait que beaucoup d’usines de production de principes actifs ont été délocalisées, pour des questions de rentabilité, vers l’Extrême Orient et que cette délocalisation est un des facteurs importants des manquements. Au-delà des solutions structurelles comme un rapatriement de la production de l’Asie vers l’Europe, que peut faire notre secteur pour alléger ces manquements dont souffrent les patients ?
- Nos membrent s’efforcent, à côté de leurs importations ordinaires, d’importer les médicaments manquants en Belgique : Durant la période 2019-2021, nous avons importé 1,3 million de mois de traitements manquants de la liste de l’AFMPS, ou plus de 1.000 traitements mensuels par jour !
Quelles leçons en tirer ?
- Par sa contribution efficace et silencieuse, l’importation parallèle aide puissamment à contrer ce problème de santé publique. C’est le moyen le plus naturel, le plus efficace contre certains problèmes de production rencontrés par l’Industrie. Sans notre contribution, le problème serait autrement plus douloureux ! La toute récente étude réalisée par le groupe Technopolis pour la Commission européenne déclare ce qui suit :
Member State authorities and healthcare providers consider parallel trade the most important competitive force in the pharmaceutical market.
En comblant des manquants, nous contribuons à la compliance du patient, qui peut poursuivre son traitement avec le même médicament. Nous évitons aussi au pharmacien des recherches et des démarches nombreuses et lui faisons gagner du temps. Le pharmacien perd de 5 à 6 heures par semaine dans des démarches pour combler ces manquants. Nos membres, en leur qualité de grossistes, sont parmi les professionnels de la santé, les mieux outillés pour importer les médicaments. Ils savent où trouver les stocks dans les différents pays de l’Union et comment les acheminer rapidement en Belgique.
- Mais nous pourrions encore faire mieux si, dès qu’un médicament était déclaré comme indisponible par l’AFMPS sur le site « PharmaStatut », nous pouvions, comme grossiste, importer ce médicament. Une solution pragmatique, basée sur l’article 5 de la Directive 2001/83/EC, est utilisée en Irlande. C’est une extension, aux grossistes, de l’autorisation individuelle d’importation par les pharmaciens que nous connaissons en Belgique. Elle permet aux grossistes irlandais d’acheter et d’importer des stocks de médicaments manquants sous contrôle de leur Agence. Si cela marche en Irlande, pourquoi nos patients belges ne pourraient-ils pas en profiter aussi ? Cela nous permettrait en tous cas d’augmenter les importations de médicaments manquants en Belgique, au bénéfice des patients.
- En résumé, pour résoudre le problème d’un médicament manquant en Belgique – mais disponible dans un autre état de l’Union – il y a deux solutions : ou bien la solution Irlandaise, sur base de l’article 5 de la Directive 2001/83/EC, ou bien l’écriture d’un article 105 bis dans l’AR du 14/12/2006 autorisant les grossistes (à côté des pharmaciens) à importer des médicaments indisponibles en Belgique. La parution de cet article est envisagée par l’AFMPS mais reste au stade des intentions jusqu’ici. Ceci permettrait une révision de l’arbre de décision utilisé par l’AFMPS. Qu’en cas d’indisponibilité l’on fasse rapidement appel au grossiste et pas seulement en fin de procédure, comme prévu actuellement. Pour le patient, cela signifierait : recevoir son traitement manquant plus rapidement.
| Recommandation 1 : Il faudrait que, dès qu’un médicament est indisponible, son importation parallèle par les grossistes “ordinaires”, les importateurs, soit possible ; qu’une autorisation temporaire d’importation, un prix et un remboursement soit délivrée. Il s’agirait soit d’utiliser l’article 5 de la Directive 2001/83/EC, soit d’écrire un article 105 bis de l’AR du 14/12/2006 pour rencontrer cet objectif. L’arbre de décision qu’utilise l’AFMPS devrait être adapté en conséquence. |
2. L’AR du 19 avril 2001 sur l’importation parallèle devrait être révisé
Cet AR a plus de 20 ans d’âge. Que propose-t-il ? que pour chaque médicament, nous constituions un dossier d’importation, que nous demandions un prix et un remboursement, le tout nécessitant une bonne année dans le meilleur des cas… ce qui ne résout pas le problème des patients quand nous constituons un dossier pour résoudre le cas d’un médicament manquant. Il va de soi que plus nous obtiendrons de licences d’importation et de distribution parallèle, plus nous pourrons aider à combattre ce lancinant problème. Notre seul souhait : que nous obtenions plus de licences d’importation parallèle – et plus rapidement- afin de d’être plus efficaces au côté du patient … et du pharmacien.
Dans les pays voisins : Allemagne, Angleterre, Pays-Bas, pays nordiques, ces dossiers sont traités en moins d’un mois… Il faudrait aussi que le prix et le remboursement, identiques au médicament de référence, soient donnés automatiquement par une procédure de notification.
Si les produits importés et les produits de référence sont jugés identiques pharmacologiquement, il ne faudrait pas qu’une différence « d’indication » textuelle entre les notices des deux pays entraine un refus (ou un retrait) de licence. En effet, l’AFMPS prend des décisions de refus/radiation des autorisations au motif que le médicament importé ne satisfait pas aux conditions de l’article 3,§2, 1° alinéa b) de l’AR du 19 avril 2001, alors que les médicaments sont identiques au niveau de leur composition qualitative et quantitative et qu’ils ont, au moins dans la pratique, les mêmes indications.
Les décisions de refus ou de radiation sont basées sur une lecture incomplète de l’article 3, §2, 1° alinéa b) de l’AR, c’est-à-dire sans tenir compte de la procédure d’évaluation des différences constatées et de l’avis rendu par la Commission des Médicaments comme prévu dans l’article 5 §3 du même AR. Il y a lieu de clarifier que les articles 3 §2 et 5 §3 de l’AR sont inextricablement liés : lorsque l’AFMPS constate des différences d’indications entre les notices du médicament importé et le médicament de référence, les autorisations ne peuvent être refusées ou radiées que lorsque (selon l’avis de la Commission des Médicaments) ces différences sont significatives au niveau thérapeutique et/ou impliquent un danger pour la santé publique.
| Recommandation 2 : Révision de l’AR du 19 avril 2001 – accélérer/simplifier la procédure d’enregistrement à l’égard des pays limitrophes ;- donner automatiquement le prix et le remboursement du médicament de référence.- si les médicaments et leurs formes sont les mêmes chimiquement entre la Belgique et le pays d’import, éviter qu’une différence textuelle éventuelle dans la formulation des « indications » entre les notices ne soit utilisée comme prétexte pour empêcher l’importation. |
3. Nos membres exportateurs s’interdisent d’exporter les médicaments critiques en manque en Belgique mais ils ne veulent pas d’un AR excessif et non-proportionnel
Nos membres exportateurs se sont engagés à ne pas exporter les médicaments critiques, manquants, sans alternative sur le marché belge (marqués en rouge foncé sur le site PharmaStatut de l’AFMPS). Chaque semaine, nous mettons à jour et communiquons à nos membres la liste de médicaments à ne pas exporter. Cette auto-obligation de non-exportation est vérifiée par l’audit TÜV indépendant que nous nous imposons statutairement. Cette non-exportation a d’ailleurs été confirmée, si besoin en est, par notre Cour constitutionnelle. On peut lire, dans l’arrêt 146/2019, p. 21 que « les parties requérantes (la BAPIE) produisent à cet égard une pièce qui atteste du fait qu’un pourcentage très marginal des médicaments réellement indisponibles a effectivement été exporté, élément qui n’a pas été réfuté (par l’Etat et l’AFMPS).
Il faut se rappeler que nos membres exportateurs sont aussi soumis à l’obligation européenne PSO (Public Service Obligation – de la Directive Européenne 2001/83 art 1, n°17 et 18). Ils ont pour obligation de servir leur propre marché avant d’en exporter les surplus. En conséquence de quoi – les exportateurs étrangers étant soumis à la même obligation – les membres importateurs n’importent que le surplus disponible. L’importation parallèle, au sens large, régularise donc en Europe les flux excédentaires, au bénéfice de tous.
Suite à l’annulation de la loi du 28 mars 2019 par la Cour Constitutionnelle (arrêt 146/2019), une nouvelle loi du 20 décembre 2019 sur les indisponibilités a prévu que le Roi puisse fixer les conditions d’une restriction d’exportation de médicaments indisponibles. Un projet d’AR découle de cette loi. Cet AR “exportation” doit être en ligne avec les critères de la Commission européenne. (cfr « Paper on the obligation of continuous supply to tackle the problem of shortages of medicines agreed by the Ad-hoc technical meeting under the Pharmaceutical Committee on shortages of medicines on 25 May 2018”).
En ce qui concerne les systèmes de notification préalable, prévus dans ce projet d’AR, il y a certains points qui devraient être amendés avant parution :
- La période de 20 jours ouvrables, que se réserve l’administration avant de prendre une décision sur une notification d’exportation, est trop longue.
Le Position Paper de 2018 de la Commission européenne énonce ce qui suit: “the notification […] procedures themselves must be proportionate in relation to their duration […] so as not to deter operators.”
L’article 6(1) du projet d’AR octroie 20 jours à l’administration pour prendre position sur la notification qui lui a été faite. C’est clairement un délai trop long, si l’on tient compte que la liberté de circulation des biens est mise à l’arrêt durant ce temps. Ce délai est disproportionné. Il est un obstacle à la distribution. L’ Espagne, le Portugal et la Norvège ne demandent que 3 jours pour prendre position sur des notifications à l’exportation. Il n’y a pas de raison que la Belgique en demande 7 fois plus…
- La possibilité de faire appel
Le Papier de 2018 de la Commission dit que: “Decisions by Member State authorities should be open to appeal before the relevant national administrative or legal bodies. Any decision of refusal to export must be open to challenge before the Courts”. Une possibilité de faire appel doit être prévue. On doit pouvoir faire appel (i) de la liste des médicaments considérée comme à risque de manquement et devant faire l’objet d’une notification, ainsi que (ii) de la décision prise de bloquer une exportation d’un médicament notifié
- Toute décision refusant une exportation doit en expliciter les raisons
Le projet d’AR n’oblige pas l’administration à justifier ses décisions de blocage d’exportation. Si l’administration ne motive pas clairement ses décisions et ses motifs, cela rend la construction d’un appel impossible.
- Le projet d’AR doit être soumis à la procédure TRIS
Le projet d’arrêté fait correctement référence à l’obligation de notification prévue à l’article 5, paragraphe 1er, de la directive (UE) 2015/1535 du Parlement européen et du Conseil du 9 septembre 2015 prévoyant une procédure d’information dans le domaine des réglementations techniques et des règles relatives aux services de la société de l’information (procédure TRIS). Il y a lieu de notifier le projet d’arrêté à la Commission, en tant que projet de mesure technique, et de respecter l’obligation de suspension prévue à l’article 6 de la directive 2015/1535.
On peut se demander ce que pensera le Grand-Duché de Luxembourg de cet AR, lui qui considère les médicaments belges comme les siens et qui se verrait interdit d’obtenir la liste des produits figurant sur l’export ban, car se situant « à l‘étranger »…
| Recommandation 3 : L’arrêté royal sur la limitation des exportations pris en application de la loi du 20 décembre 2019 devra suivre les guidances établies par la Commission européenne le 25 mai 2018. Il devra suivra la procédure TRIS. Une réponse aux notifications sera prise et commentée dans les 3 jours. Les restrictions d’exportation ne seront appliquées que pour les médicaments essentiels, en manque, pour lesquels il n’y a pas d’alternatives sur le marché belge. Cette liste sera révisée régulièrement et devra être opposable en justice. |
4. Restaurer la rentabilité des « vieux médicaments » remboursés
Il est une pratique assez constante en Belgique qui est de diminuer, année après année, le prix des vieux médicaments remboursés dès que celui-ci dépasse 5 ans (en compensation de budgets alloués à de nouveaux médicaments plus chers) et d’y ajouter une taxe de 10 % (clawback) sur le chiffre d’affaires.
A la longue, la rentabilité du médicament ancien devient négative pour la société productrice.
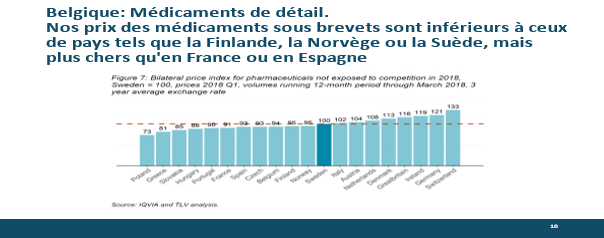
Le tableau ci-dessus examine notre niveau de prix moyen, pour les produits de détail, hors génériques, par rapport aux autres pays européens. On voit que notre niveau de prix est dans la moyenne inférieure. Nous sommes à l’indice 94 par rapport à l’indice moyen 100 occupé par la Suède. Les médicaments d’officine sont donc, globalement, peu chers en Belgique – mais nous sommes en moyenne, plus chers que la France, l’Espagne ou les pays de l’Est.
Il devient urgent, alors que tout augmente et que l’inflation fait un retour en force, de permettre la ré-augmentation du prix des anciens médicaments. Est-il raisonnable et soutenable de penser qu’un produit, une fois admis au remboursement en Belgique, voie toute augmentation de prix bloquée pour le reste de sa vie ? Nul besoin de s’étonner alors que la production se concentre dans une seule usine, puis se délocalise et que les manquements surviennent. On s’étonne, après-coup, de récolter des indisponibilités que le système a généré. Autre effet néfaste : le patient est poussé vers d’autres médicaments nouveaux, plus chers et qui ne sont pas toujours meilleurs.
Nous avons mené une étude sur les 394 présentations qui, le 1er décembre 2021, étaient signalées sur le site de l’AFMPS comme manquantes « pour des raisons commerciales » ou « pour d’autres raisons ». Nous avons exclu de cette liste 154 médicaments ayant une alternative sur le marché belge (souvent des génériques), pour n’analyser que les ‘vrais’ 240 manquants. Il est difficile de connaitre les raisons (de production ? régulatoires ? logistiques ?) de ces manquants, aussi avons-nous étudié l’aspect prix. Nous nous sommes demandé si ces produits étaient aussi manquants dans les pays voisins : l’Autriche, l’Allemagne, les Pays-Bas, la France, l’Irlande, l’Italie, l’Espagne et le Portugal. Dans 64 cas sur 240 (23 %), le prix belge était inférieur de plus de 10% au prix du produit du pays voisin dans lequel il restait disponible. On peut en conclure qu’un prix trop bas, induit un manquement et qu’une revalorisation du prix nous le rendrait probablement à nouveau disponible.
| Recommandation 4 : La BAPIE prône une revalorisation du prix des anciens médicaments remboursés, pour qu’ils continuent à rester disponibles en Belgique. Ils constituent le gros de la médecine ambulatoire dont les patients ont besoin. Ces produits doivent être exemptés de la taxe clawback et en tous cas ne pas être frappés à nouveau de diminution de prix. |
LA BAPIE SOUHAITE CONTRIBUER À L’APPROVISIONNEMENT DE MEDICAMENTS ABORDABLES
5. Ouvrir les accords de secret à la concurrence de la distribution parallèle et des génériques :
- Ces accords concernent des médicaments nouveaux à des prix très élevés.. Le plus simple et le plus sain serait de supprimer ces accords de secret ou, ce qui revient au même, à les rendre transparents, publics, ce qui en ferait des contrats ouverts à la concurrence de la distribution parallèle afin de faire baisser les prix au bénéfice de l’INAMI, de l’Etat belge et des citoyens.
- 140 formes pharmaceutiques nouvelles et chères ont bénéficié entre 2010 et mi-2017 de « conventions article 81 », appelées maintenant « conventions article 111 ». Ces conventions remboursent des médicaments avec un prix facial et officiel élevé, alors que le prix réel, avec ses remises, est tenu secret. Ces conventions de remboursement sont en principe temporaires (1, 3 ou 5 ans), mais sont dans la pratique renouvelées. Ces conventions excluent la compétition pour la durée de la convention. Parallèlement, de « vieilles » molécules, à bas prix, sont retirées du marché.
- En 2021, 70 produits de distribution parallèle (produits identiques venant d’un autre pays de l’Union) ont voulu entrer en concurrence dans ce marché. En vain, l’accès au remboursement leur a été refusé.
Sachant que ces accords de secret mobilisent déjà 1/3 du budget des médicaments (1,6 milliard sur 4,2 en 2019), qu’est-ce qui bloque les distributeurs parallèles (et les génériques) dans leur entrée dans ces contrats ?
Ce ne sont pas des considérations financières puisque les distributeurs parallèles sont prêts à offrir à l’Etat et à l’INAMI des ristournes égales ou supérieures, à celles données par les sociétés de référence. L’attribution d’un code CNK propre au distributeur parallèle permet d’éviter toute confusion entre fournisseurs. Ce qui bloque, ce serait un article de l’AR 1er février 2018. L’article 115 3° demande de « fournir les modalités relatives au rapport et à l’évaluation scientifique ». Pour accorder le remboursement à un distributeur parallèle pour une spécialité, l’INAMI exigerait des importateurs et distributeurs parallèles de remplir les mêmes critères que les laboratoires pharmaceutiques ce qui, dans les faits, est tout à fait impossible puisque le statut et l’activité d’un distributeur/importateur parallèle sont complètement différents de ceux d’un laboratoire pharmaceutique. En effet, ceux-ci n’ont aucune activité de recherche, de développement et de production et ne disposent pas de l’arsenal scientifique des laboratoires. Il est donc impossible pour eux de fournir certaines informations qui pourraient entrer, par exemple, dans le cadre d’essais cliniques. Cependant, nos membres sont prêts à fournir à l’INAMI les données de pharmacovigilances récoltées pour leurs produits, ce qui contribuerait à la connaissance des effets secondaires de ces nouveaux produits.
Si l’on veut introduire de la concurrence dans ces « accords secrets » et induire une pression baissière sur les prix, il conviendrait d’arrêter automatiquement une convention dès qu’une alternative se fait jour, comme une autorisation de distribution parallèle, ou l’arrivée d’un générique et d’imposer l’organisation d’appels d’offre, produit par produit, au niveau hospitalier. Encore faut-il que nos autorités rendent possible l’arrivée d’une concurrence en ouvrant au remboursement la voie de distribution parallèle.
| Recommandation 5 : Les accords de secret – les supprimer ; – ou à tout le moins permettre l’entrée en concurrence des distributeurs parallèles et des génériques ; – supprimer ou modifier dans l’AR du 1er février 2018 le passage de l’Art 115, 3° qui exclut de fait toute concurrence. – organiser dès qu’il y a concurrence, des appels d’offre au niveau local ou pour des durées bien définies. – faire en sorte que les hôpitaux et l’INAMI, profitent de cette pression baissière sur les prix. |