INLEIDING
BAPIE (vzw) is de beroepsvereniging van parallelle invoerders, uitvoerders en distributeurs van geneesmiddelen in België. Deze ‘short range’ groothandelaars hebben een beperkt assortiment geneesmiddelen in voorraad, die ze heel goed kennen omdat ze voor elk van die geneesmiddelen een vergunning voor het in de handel brengen hebben verkregen – niet te verwarren met groothandelaars-verdelers, die het hele assortiment geneesmiddelen in voorraad hebben in hun winkels zonder vergunning voor het in de handel brengen. BAPIE werd opgericht in 2012 en viert in 2022 haar tiende verjaardag. Tot haar leden behoren de meeste ondernemingen die op dit gebied actief zijn. Hun activiteit was in 2021 goed voor 3,7% van de Belgische markt voor officinale geneesmiddelen, tegenover 2% in 2019.
PARALLELLE INVOER IS DE ENIGE CONCURRENTIE VOOR GEOCTROOIEERDE GENEESMIDDELEN
Door producten te importeren, zetten parallelle invoerders een neerwaartse druk op de prijzen via het marktaandeel dat ze op een product innemen. Zonder deze concurrentie zou de farmaceutische industrie geen enkele challenge hebben op de opgezette prijsstructuur. Meerdere voorbeelden (Livial, Lipitor …) hebben aanzienlijke prijsverlagingen laten zien in het voordeel van de patiënt en de gezondheidsbegroting, na het commerciële succes van parallel ingevoerde producten. Wanneer parallelimport een groot marktaandeel van een product verovert, heeft het referentielaboratorium geen andere oplossing dan zijn prijzen te verlagen – tot een niveau waarop de parallelimporteur niet meer kan volgen – om het verloren marktaandeel terug te winnen. Het verkrijgen en verwerken van parallelle vergunningsdossiers zou dus sneller en gemakkelijker moeten worden. Door de neerwaartse druk op de prijzen die ze uitoefent, speelt de parallelle invoer immers een rol als concurrentiewaakhond. Wanneer collega-importeurs prijsverlagingen verkrijgen in het buitenland, is deze druk via het referentieprijssysteem ook voelbaar in België. Tot slot worden prijsstijgingen in België vermeden, omdat die concurrentiemogelijkheden voor de parallelhandel zouden scheppen.
Ter herinnering:
- Elk van onze leden heeft van het FAGG het statuut van groothandelaar in farmaceutische producten bekomen en wordt door het agentschap gecontroleerd.
- Elk bedrijf heeft een verantwoordelijke apotheker die de procedures vaststelt volgens dewelke het bedrijf werkt.
- Al onze leden houden zich aan de GDP-normen (Good Distribution Practices). Bovendien voldoen importeurs en distributeurs ook aan de GMP-normen (Good Manufacturing Practices) voor hun herverpakkingsactiviteiten in erkende installaties.
- Onze leden kopen hun geneesmiddelen alleen binnen de EU.
- Ze oefenen hun activiteiten uit met strikte naleving van de regelgeving. Ze zijn onder meer onderworpen aan de PSO (Public Service Obligation: eerst binnenlandse levering, dan pas uitvoer). Zie artikel 81 van de Europese Richtlijn 2001/83/EG en, in België, het KB van 19 april 2001.
- De BAPIE-leden zijn statutair onderworpen aan een onafhankelijke audit door TÜV. Deze audit gaat verder dan de GDP-verplichtingen en besteedt bijzondere aandacht aan de supply chain van elk lid. Er wordt onder meer op toegezien dat we geen kritische producten uitvoeren waarvan er een tekort is op onze markt. Onze buitenlandse collega’s, die ook aan deze TÜV-audit zijn onderworpen, voeren geen producten uit met een exportverbod in hun land. Dit betekent dat deze import-exportstroom niet tot tekorten in een bepaald EU-land leidt, maar er juist toe bijdraagt dat aan de vraag in elk land wordt voldaan, terwijl tegelijkertijd een neerwaartse druk op de prijzen wordt uitgeoefend.
1. BAPIE-leden dragen bij aan de strijd tegen het tekort aan geneesmiddelen
- Er wordt regelmatig melding gemaakt van tekorten in de supply chain in ons land, maar ook in Europa en de rest van de wereld. De website van het FAGG geeft de oorzaak van deze tekorten aan: in 49% van de gevallen zijn die te wijten aan vertragingen in de levering, in 15% aan productieproblemen, in 13% aan productievertragingen, in 4,6% aan een stijging van de vraag, in 2,8% aan logistieke problemen (transport, douane), in 2% aan het feit dat de werkzame stof (API) niet meer beschikbaar is, in 13% wordt “een andere reden” opgegeven. Kortom, alle oorzaken die verband houden met de organisatie (of het gebrek daaraan) van bepaalde ondernemingen in de farmaceutische industrie.
- We weten dat veel fabrieken die actieve bestanddelen produceren omwille van rentabiliteit naar het Verre Oosten zijn verplaatst en dat die delokalisatie een van de belangrijkste factoren is voor de tekorten. Wat kan onze sector doen, afgezien van structurele oplossingen zoals het repatriëren van de productie van Azië naar Europa, om deze tekorten waaronder patiënten te lijden hebben te verhelpen?
- Onze leden trachten, naast hun reguliere invoer, de ontbrekende medicijnen in België in te voeren: In de periode 2019-2021 importeerden we 1,3 miljoen maanden aan ontbrekende behandelingen uit de FAGG-lijst, of meer dan 1.000 maandbehandelingen per dag!
Welke lessen geleerd?
- Door zijn stille en efficiënte bijdrage helpt parallelle invoer dit volksgezondheidsprobleem krachtig te bestrijden. Het is de natuurlijkste en doeltreffendste manier om een aantal productieproblemen in de industrie tegen te gaan. Zonder onze bijdrage zou het probleem veel pijnlijker zijn!
De recente studie van de Technopolis-groep voor de Europese Commissie stelt dat:
Member State authorities and healthcare providers consider parallel trade the most important competitive force in the pharmaceutical market.
Door de leemten op te vullen, dragen we bij tot de therapietrouw van de patiënt, die zijn behandeling met hetzelfde geneesmiddel kan voortzetten. We besparen de apotheker ook een hoop onderzoek en tijd. Apothekers verliezen 5 tot 6 uur per week met het opvullen van deze leemten. Onze leden behoren als groothandelaars tot de gezondheidsprofessionals die het best uitgerust zijn om geneesmiddelen in te voeren. Ze weten waar ze in de verschillende EU-landen voorraden kunnen vinden en hoe die snel in België te krijgen.
- Maar we zouden nog beter kunnen doen als we, zodra een geneesmiddel door het FAGG als onbeschikbaar wordt verklaard op de website FarmaStatus, dit geneesmiddel als groothandelaar zouden kunnen invoeren. In Ierland gebruiken ze een pragmatische oplossing, gebaseerd op artikel 5 van Richtlijn 2001/83/EG. Het is een uitbreiding tot de groothandel van de individuele invoervergunning voor apothekers die we in België kennen. Het laat de Ierse groothandelaars toe voorraden van ontbrekende geneesmiddelen te kopen en in te voeren onder toezicht van hun agentschap. Als dit in Ierland werkt, waarom zouden onze Belgische patiënten er dan niet van kunnen profiteren? Het zou ons in ieder geval in staat stellen de invoer van ontbrekende geneesmiddelen in België te verhogen, ten gunste van de patiënten. Kortom, om het probleem op te lossen van een geneesmiddel dat in België ontbreekt maar in een ander EU-land beschikbaar is, zijn er twee opties: ofwel de Ierse oplossing, gebaseerd op artikel 5 van Richtlijn 2001/83/EG, ofwel het invoegen van een artikel 105 bis in het KB van 14/12/2006 dat groothandelaars (naast apothekers) toelaat geneesmiddelen in te voeren die onbeschikbaar zijn in België. Het FAGG overweegt de publicatie van dit artikel, maar tot nu toe blijft het bij intenties. Dit zou een herziening van de door het FAGG gebruikte beslissingsboom mogelijk maken. Dat in geval van onbeschikbaarheid snel een beroep wordt gedaan op de groothandelaar en niet pas aan het eind van de procedure, zoals nu is voorzien. Voor de patiënt zou dit betekenen dat hij sneller zijn ontbrekende behandeling ontvangt.
|
Aanbeveling 1: Zodra een geneesmiddel onbeschikbaar is, moet het door ‘gewone’ groothandelaars, importeurs, parallel kunnen worden ingevoerd en moet er een tijdelijke invoervergunning, een prijs en een terugbetaling afgeleverd worden. Dit betekent ofwel artikel 5 van Richtlijn 2001/83/EG gebruiken, ofwel een artikel 105 bis van het KB van 14/12/2006 schrijven om dit doel te bereiken. De door het FAGG gebruikte beslissingsboom moet dan dienovereenkomstig aangepast worden. |
2. Het KB van 19 april 2001 betreffende de parallelle invoer moet herzien worden
Dit KB is meer dan 20 jaar oud. Wat zegt het? Dat we voor elk geneesmiddel een importdossier aanleggen en een prijs en terugbetaling aanvragen. In het beste geval duurt dit ruim een jaar, wat de patiënten niet helpt wanneer we een dossier aanleggen om het probleem van een ontbrekend geneesmiddel op te lossen. Het spreekt vanzelf dat hoe meer vergunningen voor parallelle invoer en distributie we verkrijgen, hoe meer we dit knagende probleem kunnen helpen bestrijden. Onze enige wens is dat we meer – en sneller – parallelle invoervergunningen krijgen, zodat we efficiënter kunnen optreden langs de kant van de patiënt … en de apotheker.
In buurlanden zoals Duitsland, Engeland, Nederland en in de Scandinavische landen worden deze dossiers in minder dan een maand afgehandeld. De prijs en terugbetaling, identiek aan die van het referentiegeneesmiddel, moeten ook automatisch worden gegeven via een kennisgevingsprocedure.
Als de ingevoerde en de referentieproducten farmacologisch identiek worden geacht, mag een tekstueel verschil in de ‘indicatie’ tussen de bijsluiters van de twee landen niet leiden tot een weigering (of intrekking) van een vergunning. Het FAGG neemt immers beslissingen tot weigering/schrapping van vergunningen omdat het ingevoerde geneesmiddel niet voldoet aan de voorwaarden van artikel 3, §2, 1°, alinea b) van het KB van 19 april 2001, ook al zijn de geneesmiddelen identiek wat hun kwalitatieve en kwantitatieve samenstelling betreft en hebben ze, althans in de praktijk, dezelfde indicaties.
De weigerings- of schrappingsbeslissingen berusten op een onvolledige lezing van artikel 3, §2, 1° alinea b) van het KB, d.w.z. zonder rekening te houden met de evaluatieprocedure van de vastgestelde verschillen en het advies van de Commissie voor Geneesmiddelen zoals voorzien in artikel 5 §3 van hetzelfde KB. Het moet worden verduidelijkt dat de artikelen 3 §2 en 5 §3 van het KB onlosmakelijk met elkaar verbonden zijn: wanneer het FAGG verschillen vaststelt in de indicaties tussen de bijsluiters van het ingevoerde en het referentiegeneesmiddel, kan de vergunning slechts worden geweigerd of geschrapt als (volgens het advies van de Commissie voor Geneesmiddelen) deze verschillen therapeutisch significant zijn en/of een gevaar inhouden voor de volksgezondheid.
|
Aanbeveling 2 : Herziening van het KB van 19 april 2001 – de registratieprocedure versnellen/vereenvoudigen naar het voorbeeld van de buurlanden; |
3. Onze exporterende leden voeren geen kritieke geneesmiddelen uit waaraan in België een tekort is, maar ze willen geen buitensporig en onevenredig KB
Onze exporterende leden verbinden zich ertoe geen kritieke, ontbrekende geneesmiddelen uit te voeren zonder alternatief op de Belgische markt (aangeduid in donkerrood op de website FarmaStatus van het FAGG). Elke week updaten we de lijst van geneesmiddelen die niet mogen uitgevoerd worden en bezorgen we die aan onze leden. Deze zelf opgelegde niet-uitvoerverplichting wordt geverifieerd door de onafhankelijke TÜV-audit die we onszelf statutair opleggen. Deze niet-uitvoer is ook bevestigd door ons Grondwettelijk Hof. In arrest 146/2019, blz. 21, lezen we: “de verzoekende partijen (BAPIE) leggen in dat verband een stuk voorleggen waaruit blijkt dat van de werkelijk onbeschikbare geneesmiddelen een zeer marginaal percentage ook effectief werd geëxporteerd, een gegeven dat niet werd weerlegd (door de Staat en het FAGG).”
We herinneren eraan dat onze exporterende leden ook onderworpen zijn aan de Europese ODV (Public Service Obligation – van de Europese Richtlijn 2001/83 art 1, n° 17 en 18). Ze zijn verplicht hun eigen markt te bedienen alvorens het overschot te exporteren. Daardoor – buitenlandse exporteurs zijn aan dezelfde verplichting onderworpen – voeren importerende leden alleen het beschikbare overschot in. Parallelle invoer, in de ruime zin van het woord, regulariseert dus de overschottenstromen in Europa, wat iedereen ten goede komt.
Na de vernietiging van de wet van 28 maart 2019 door het Grondwettelijk Hof (arrest 146/2019), voorziet een nieuwe wet van 20 december 2019 dat de Koning de voorwaarden kan bepalen voor een uitvoerbeperking van onbeschikbare geneesmiddelen. Uit deze wet volgt een ontwerp van koninklijk besluit. Dit ‘export’ KB moet in overeenstemming zijn met de criteria van de Europese Commissie. (cfr ‘Paper on the obligation of continuous supply to tackle the problem of shortages of medicines agreed by the Ad-hoc technical meeting under the Pharmaceutical Committee on shortages of medicines on 25 May 2018’).
Wat betreft de systemen van voorafgaande kennisgeving, voorzien in dit ontwerp van koninklijk besluit, zouden enkele punten moeten geamendeerd worden vóór publicatie:
- De termijn van 20 werkdagen die de administratie zichzelf toekent alvorens een besluit te nemen over een kennisgeving van uitvoer, is te lang.
De Position Paper uit 2018 van de Europese Commissie stelt: “the notification […] procedures themselves must be proportionate in relation to their duration […] so as not to deter operators.”
Artikel 6(1) van het ontwerp van koninklijk besluit geeft de administratie 20 dagen de tijd om een standpunt in te nemen over de kennisgeving die ze heeft ontvangen. Dit is duidelijk te lang, rekening houdend met het feit dat het vrije verkeer van goederen gedurende deze periode wordt stilgelegd. Deze termijn is onevenredig en een belemmering voor de distributie. Spanje, Portugal en Noorwegen hebben slechts drie dagen nodig om een standpunt in te nemen over kennisgevingen van uitvoer. Er is geen enkele reden waarom België 7 keer zolang nodig heeft …
- Mogelijkheid tot beroep
De Paper uit 2018 van de Europese Commissie stelt: “Decisions by Member State authorities should be open to appeal before the relevant national administrative or legal bodies. Any decision of refusal to export must be open to challenge before the Courts”. Er moet een mogelijkheid tot beroep worden geboden. Het moet mogelijk zijn beroep aan te tekenen tegen (i) de lijst van geneesmiddelen die worden geacht het risico te lopen onbeschikbaar te zijn en waarvoor een kennisgeving vereist is, en tegen (ii) het besluit om de uitvoer van een gemeld geneesmiddel te blokkeren.
- Elk besluit tot weigering van uitvoer moet uitdrukkelijk de redenen uitleggen
Het ontwerp van koninklijk besluit verplicht de administratie niet haar besluiten tot blokkering van de uitvoer te motiveren. Als de administratie haar beslissingen en motieven niet duidelijk verklaart, is beroep aantekenen onmogelijk.
- Het ontwerp van koninklijk besluit moet de TRIS-procedure volgen
Het ontwerp van koninklijk besluit verwijst terecht naar de kennisgevingsverplichting van artikel 5, paragraaf 1, van Richtlijn (EU) 2015/1535 van het Europees Parlement en de Raad van 9 september 2015 betreffende een informatieprocedure op het gebied van technische voorschriften en regels inzake de diensten van de informatiemaatschappij (TRIS-procedure). Het ontwerp van koninklijk besluit moet bij de Commissie worden aangemeld als een ontwerp voor een technisch voorschrift en de uitstelverplichting van artikel 6 van Richtlijn 2015/1535 moet in acht worden genomen.
Je kan je afvragen wat het Groothertogdom Luxemburg denkt van dit KB, aangezien het Belgische geneesmiddelen als de zijne beschouwt en het geen toegang zou krijgen tot de lijst van producten met een uitvoerverbod omdat ze “in het buitenland” zijn…
|
Aanbeveling 3: Het koninklijk besluit inzake exportbeperkingen dat ter uitvoering van de wet van 20 december 2019 wordt uitgevaardigd, moet de richtlijnen volgen die de Europese Commissie op 25 mei 2018 heeft vastgesteld. Het moet de TRIS-procedure volgen. Binnen de 3 dagen zal een gemotiveerd antwoord op de kennisgevingen volgen. Uitvoerbeperkingen zullen alleen worden toegepast voor essentiële geneesmiddelen waarvan een tekort bestaat en waarvoor geen alternatieven zijn op de Belgische markt. Deze lijst zal regelmatig worden herzien en zou in rechte afdwingbaar moeten zijn. |
4. De rendabiliteit van terugbetaalde ‘oude geneesmiddelen’ herstellen
Het is een vrij constante praktijk in België om jaar na jaar de prijs van oude terugbetaalde geneesmiddelen te verlagen zodra die meer dan 5 jaar oud zijn (om budgetten te compenseren die aan nieuwe, duurdere geneesmiddelen worden toegekend) en om een belasting van 10% (clawback) op de omzet toe te voegen.
Op lange termijn wordt de winstgevendheid van het oude geneesmiddel negatief voor de producerende onderneming.
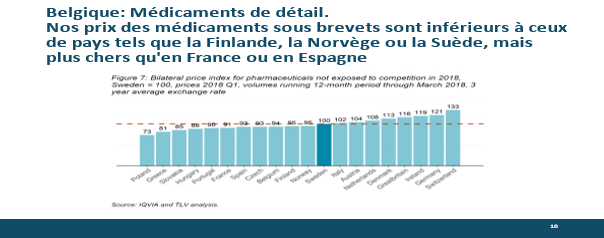
Bovenstaande tabel toont ons het gemiddelde prijsniveau voor detailhandelsproducten, exclusief generieke producten, in vergelijking met andere Europese landen. We zien dat ons prijsniveau in het lagere gemiddelde ligt. We staan op index 94 vergeleken met de gemiddelde index van 100 in Zweden. In het algemeen zijn officinale geneesmiddelen in België dus niet erg duur – maar we zijn gemiddeld duurder dan Frankrijk, Spanje of de Oost-Europese landen.
Nu alles duurder wordt en de inflatie een sterke comeback maakt, is het hoog tijd om de prijs van oude geneesmiddelen weer te laten stijgen. Is het redelijk en houdbaar te denken dat een product, eenmaal toegelaten tot terugbetaling in België, voor de rest van zijn levensduur nooit meer een prijsstijging mag kennen? Dan is het niet verwonderlijk dat de productie in één fabriek wordt geconcentreerd, vervolgens wordt gedelokaliseerd en dat er tekorten optreden. En achteraf wordt verbaasd vastgesteld dat het systeem onbeschikbaarheid heeft gegenereerd. Een ander negatief effect is dat patiënten in de richting van andere nieuwe, duurdere en niet altijd betere geneesmiddelen worden geduwd.
We hebben de 394 presentaties onderzocht die op 1 december 2021 op de website van het FAGG als ontbrekend waren gerapporteerd “om commerciële redenen” of “om andere redenen”. We hebben 154 geneesmiddelen met een alternatief op de Belgische markt (vaak generieke geneesmiddelen) van deze lijst uitgesloten, om alleen de 240 ‘echt’ ontbrekende geneesmiddelen te analyseren. Het is moeilijk de redenen (productie? regelgeving? logistiek?) voor deze tekorten te achterhalen, daarom hebben we naar het prijsaspect gekeken. We vroegen ons af of deze producten ook ontbraken in de buurlanden: Oostenrijk, Duitsland, Nederland, Frankrijk, Ierland, Italië, Spanje en Portugal. In 64 van de 240 gevallen (23%) was de Belgische prijs meer dan 10% lager dan de prijs van het product in het buurland waar het nog verkrijgbaar was. We kunnen hieruit besluiten dat een te lage prijs tot schaarste leidt en dat een revalorisatie van de prijs het product waarschijnlijk weer beschikbaar zou maken.
|
Aanbeveling 4 : BAPIE pleit voor een revalorisatie van de prijs van oude terugbetaalde geneesmiddelen, zodat ze beschikbaar blijven in België. Ze vormen het gros van de ambulante geneesmiddelen die patiënten nodig hebben. Deze producten moeten worden vrijgesteld van de clawbacktaks en in elk geval niet worden onderworpen aan verdere prijsverlagingen. |
BAPIE WIL BIJDRAGEN TOT DE BEVOORRADING VAN BETAALBARE GENEESMIDDELEN
5. Openstellen van geheimhoudingsovereenkomsten voor de concurrentie van parallelle distributie en generieke geneesmiddelen:
- Deze overeenkomsten hebben betrekking op nieuwe geneesmiddelen met erg hoge prijzen. Het eenvoudigste en gezondste zou zijn deze geheimhoudingsovereenkomsten af te schaffen of, wat op hetzelfde neerkomt, transparant en openbaar te maken. Daardoor zouden de contracten opengesteld worden voor de concurrentie van de parallelle distributie, om de prijzen te doen dalen ten voordele van het RIZIV, de Belgische Staat en de burgers.
- 140 nieuwe en dure farmaceutische vormen hebben tussen 2010 en medio 2017 geprofiteerd van “artikel 81-overeenkomsten”, die nu “artikel 111-overeenkomsten” worden genoemd. Deze overeenkomsten betalen geneesmiddelen met een hoge officiële nominale prijs terug, terwijl de werkelijke prijs, met zijn kortingen, geheim wordt gehouden. Deze terugbetalingsovereenkomsten zijn in principe tijdelijk (1, 3 of 5 jaar), maar worden in de praktijk verlengd. Ze sluiten concurrentie uit voor de duur van de overeenkomst. Tegelijkertijd worden ‘oude’ laaggeprijsde moleculen van de markt gehaald.
- In 2021 wilden 70 producten uit de parallelle distributie (identieke producten uit een ander EU-land) op deze markt concurreren. Tevergeefs, want ze kregen geen toegang tot terugbetaling.
Deze geheimhoudingsovereenkomsten mobiliseren al 1/3 van het geneesmiddelenbudget (1,6 miljard van de 4,2 in 2019), dus wat weerhoudt parallelle distributeurs (en generieke geneesmiddelen) van deze contracten?
Het gaat hier niet om financiële overwegingen, aangezien de parallelle distributeurs bereid zijn de staat en het RIZIV kortingen aan te bieden die gelijk zijn aan of hoger dan die van de referentiebedrijven. Door een specifieke CNK-code toe te wijzen aan de parallelle distributeur wordt verwarring tussen leveranciers vermeden. Wat blokkeert, is een artikel van het KB van 1 februari 2018. Artikel 115 3° vereist “het verstrekken van de modaliteiten met betrekking tot de wetenschappelijke rapportering en evaluatie”. Om de terugbetaling toe te kennen aan een parallelle distributeur voor een specialiteit, zou het RIZIV eisen dat parallelle importeurs en -distributeurs aan dezelfde criteria voldoen als farmaceutische laboratoria, wat in feite volstrekt onmogelijk is aangezien het statuut en de activiteit van een parallelle distributeur/importeur volledig verschillen van die van een farmaceutisch laboratorium. Zij hebben immers geen onderzoeks-, ontwikkelings- en productieactiviteiten, en beschikken niet over het wetenschappelijk arsenaal van laboratoria. Het is voor hen dus onmogelijk bepaalde informatie te verstrekken die bijvoorbeeld in klinische proeven zou kunnen worden gebruikt. Onze leden zijn echter bereid het RIZIV de geneesmiddelenbewakingsgegevens te verstrekken voor hun producten, wat zou bijdragen tot de kennis over de bijwerkingen van deze nieuwe producten.
Als men concurrentie in deze ‘geheime overeenkomsten’ wil introduceren en een neerwaartse druk op de prijzen wil uitoefenen, zou een overeenkomst automatisch beëindigd moeten worden zodra zich een alternatief aandient, zoals een vergunning voor parallelle distributie of de komst van een generiek product, en zou de organisatie van aanbestedingen, product per product, op ziekenhuisniveau moeten opgelegd worden. Onze autoriteiten moeten concurrentie dan wel mogelijk maken door de parallelle distributie open te stellen voor terugbetaling.
|
Aanbeveling 5: Geheimhoudingsovereenkomsten – ze afschaffen; |